Orgaaninen kemia
Tämä artikkeli käsittelee Orgaaninen kemia:tä, erittäin relevanttia aihetta, joka on herättänyt kiinnostusta ja keskustelua eri aloilla. Asiantuntijat ja tutkijat ovat tutkineet, analysoineet ja pohtineet Orgaaninen kemia:tä, jotka ovat pyrkineet ymmärtämään sen vaikutuksia, seurauksia ja mahdollisia ratkaisuja. Eri näkökulmista Orgaaninen kemia:tä on pyritty käsittelemään kokonaisvaltaisesti ottaen huomioon sen moniulotteisuus ja monimutkaisuus. Tässä mielessä artikkeli pyrkii osallistumaan Orgaaninen kemia:n ympärillä käytävään keskusteluun tarjoamalla yksityiskohtaisen, perustellun ja objektiivisen analyysin, joka osaltaan rikastuttaa tätä aihetta koskevaa tietämystä.

Orgaaninen kemia on hiiliyhdisteiden kemiaa. Se on luonnon ja synteettisten orgaanisten yhdisteiden kemiaa.
Orgaanisen kemian kehitys
Orgaanisen kemian juuret ovat noin 1700-luvun puolessavälissä, jolloin kemia alkoi muovautua alkemiasta oikeaksi luonnontieteeksi. Tuolloin eliöissä esiintyvien aineiden tiedettiin poikkeavan merkittävästi niistä, joita oli eristetty mineraaleista. Orgaaniset aineet olivat vaikeasti eristettäviä ja puhdistettavia. Ruotsalainen kemisti Torbern Bergman oli ensimmäinen, joka jaotteli yhdisteitä orgaanisiin ja epäorgaanisiin. Hän käytti jaottelua tutkimuksissaan 1770-luvulla. Orgaanisen kemian käsite yleistyi 1800-luvun alussa tarkoittamaan eliöissä olevien aineiden kemiaa.
Useat tuon ajan kemistit uskoivat orgaanisten yhdisteiden sisältävän jonkinlaista "elämänvoimaa" eikä niitä voitaisi sen vuoksi käsitellä laboratoriossa epäorgaanisten aineiden tapaan. Kyseinen vitalismiksi kutsuttu teoria järkkyi kuitenkin jo 1816, jolloin Michel Chevreul todisti, että saippua
| Tämän artikkelin tai sen osan paikkansapitävyys on kyseenalaistettu. Voit auttaa varmistamaan, että kyseenalaistetut väittämät ovat luotettavasti lähteistettyjä. Lisää tietoa saattaa olla keskustelusivulla. Tarkennus: saippua on rasvahapon natriumsuola, rasvat ovat rasvahappojen ja glyserolin estereitä |
voitiin jakaa orgaanisiin aineisiin – glyseriiniin ja rasvahappoihin – ilman ulkopuolista "elämänvoimaa". Kymmenen vuotta myöhemmin Friedrich Wöhler murensi lisää vitalismiteoriaa valmistaessaan orgaanista ureaa ammoniumsyanaatista, joka oli epäorgaaninen suola. 1800-luvun puolivälissä "elämänvoimaan" ei enää yleisesti uskottu, ja orgaanisen ja epäorgaanisen kemian raja ymmärrettiin häilyväksi. Orgaanisessa ja epäorgaanisessa kemiassa pätivät samat lait. Ainoa perustavanlaatuinen ero oli kaikkien orgaanisten yhdisteiden sisältämä hiili.
Kemian kehitys mahdollisti myöhemmin orgaanisten yhdisteiden valmistamisen synteettisesti laboratoriossa. Muovien ja muiden luonnossa esiintymättömien, mutta orgaanisten yhdisteiden valmistus tuli mahdolliseksi. Lisäksi monien luonnossa esiintyvien orgaanisten yhdisteiden valmistus laboratoriossa kävi halvemmaksi kuin yhdisteiden hankkiminen luonnosta. Esimerkiksi kipulääkkeisiin pajunkuoresta saatu aspiriini on jo yli sadan vuoden ajan korvattu synteettisellä aspiriinilla.
Orgaaninen kemia nykyisin
Kemiallisia yhdisteitä tunnetaan jo yli 50 miljoonaa[1] ja orgaanisten yhdisteiden osuus kaikista tunnetuista kemiallisista yhdisteistä on yli 95 %. Orgaanisen kemian hiilirakenteilla on keskeinen merkitys nanotieteisiin.
Orgaanisen kemian moderni tutkimus voidaan jakaa karkeasti orgaanisten yhdisteiden valmistamisen tutkimukseen eli syntetiikkaan ja orgaanisten yhdisteiden ominaisuuksien ja pitoisuuksien tutkimukseen eli analytiikkaan. Synteettinen orgaaninen kemia tuottaa uusia orgaanisia yhdisteitä, esimerkiksi lääkkeiden aktiivisia komponentteja, lääkeaineita. Uusien synteesimenetelmien kehittäminen on tärkeä orgaanisen kemian tutkimusalue. Analytiikka keskittyy synteettisten tai luonnossa esiintyvien aineiden rakenteiden, ominaisuuksien ja pitoisuuksien tutkimiseen. Orgaanisten yhdisteiden rakenteita määritetään spektrometrisillä menetelmillä (UV, IR, NMR ja massaspektrit). Orgaanisia yhdisteitä voidaan erottaa toisistaan ja niiden pitoisuuksia voidaan määrittää kromatografisilla menetelmillä. Orgaaninen kemia tutkii ja vertailee hiiliyhdisteiden rakenteita ja ominaisuuksia.
Nykyisin pelkästään elollisen luontoon keskittyvää kemianalaa kutsutaan biokemiaksi.
Orgaanisen kemian keskeisiä käsitteitä
Hiili
- Pääartikkeli: Hiili.
Jaksollisen järjestelmän 14. ryhmään kuuluva hiili on orgaanisen kemian perusta. Hiili muodostaa kovalenttisia sidoksia useiden aineiden kanssa.
- Hiili voi sitoutua kovalenttisesti muihin hiiliatomeihin yksinkertaisella-, kaksois- ja kolmoissidoksella. Näin voi muodostua hiilirakenteita yksinkertaisista ketjuista monimutkaisiin rengas- ja pallorakenteisiin. Erilaisia hiilirakenteita on teoriassa ääretön määrä.
- Hiili voi sitoutua kovalenttisesti myös vetyyn, halogeeneihin, happeen, typpeen ja rikkiin. Vetyyn ja halogeeneihin kovalenttinen sidos on aina yksinkertainen. Typen, hapen ja rikin kanssa kovalenttinen sidos voi olla myös kaksoissidos, typen ja positiivisesti varautuneen hapen kanssa jopa kolmoissidos.
Jokainen hiiliatomi muodostaa aina joko
- neljä yksinkertaista kovalenttista sidosta
- kaksi kaksoissidosta
- yhden kaksoissidoksen ja kaksi yksinkertaista sidosta tai
- yhden kolmoissidoksen ja yhden yksinkertaisen sidoksen.
Hiiliatomien väliset sidokset ovat lujia. Sen vuoksi hiiliyhdisteet eivät ole kovin reaktiivisia.
Hiilivedyt
- Pääartikkeli: Hiilivety
Hiili muodostaa helposti kovalenttisen sidoksen vedyn kanssa. Hiilivedyt ovat orgaanisia yhdisteitä, joissa on vain hiiltä ja vetyä. Yksinkertaisin hiilivety on metaani. Siinä yhteen hiiliatomiin on kovalenttisesti sitoutunut neljä vetyatomia.
Erilaisia hiilivetyjä
Alifaattiset eli avoketjuiset hiilivedyt:
- alkaanit (metaani, etaani, propaani, butaani,...), joissa on vain yksinkertaisia kovalenttisia sidoksia
- alkeenit (eteeni, propeeni, buteeni,...), joissa on ainakin yksi hiilten välinen kaksoissidos
- alkyynit (etyyni, propyyni, butyyni,...), joissa on ainakin yksi hiilten välinen kolmoissidos
Sykliset hiilivedyt:
- sykloalkaanit (syklopropaani, syklobutaani, syklopentaani,...), jotka ovat kuin alkaaneita, mutta muodostavat rengasrakenteen
- sykloalkeenit
- sykloalkyynit
- aromaattiset hiilivedyt (esimerkiksi bentseeni)
Hiilen sidos vedyn kanssa on heikosti poolinen, sillä hiilen ja vedyn elektronegatiivisuusero on 0,4. Hiilivedyt ovat kuitenkin usein poolittomia, sillä poolisuus kumoutuu yhdisteen muodon vuoksi. Hiilivetyjen välille muodostuu tällöin vain dispersiovoimia, jotka ovat luonteeltaan heikkoja.
Funktionaaliset ryhmät
Orgaaniset yhdisteet luokitellaan usein niiden sisältämien toiminnallisten eli funktionaalisten ryhmien mukaan. Kaksois- ja kolmoissidokset katsotaan myös funktionaalisiksi ryhmiksi ja niiden perusteella tapahtuu orgaanisten yhdisteiden luokittelu alkeeneihin ja alkyyneihin. Funktionaalisella ryhmällä on suuri merkitys siihen, miten orgaaninen yhdiste reagoi.
Orgaanisten yhdisteiden luokittelu funktionaalisten ryhmien mukaan
Toiminnallisen ryhmän perusteella orgaaniset yhdisteet ryhmitellään
- alkaaneihin, jolloin toiminnallisia ryhmiä ei ole
- alkeeneihin, jolloin toiminnallinen ryhmä on kaksoissidos
- alkyyneihin, jolloin toiminnallinen ryhmä on kolmoissidos
- aromaattisiin yhdisteisiin, jolloin toiminnallinen ryhmä on bentseenirengas
- alkoholeihin, jolloin toiminnallinen ryhmä on hydroksyyli, -OH
- fenoleihin, jolloin toiminnallinen ryhmä on fenolinen hydroksyyli (bentseenirenkaaseen liittynyt hydroksyyli)
- eettereihin, jolloin toiminnallinen ryhmä on ns. happisilta -O-
- amiineihin, jolloin toiminnallinen ryhmä on amiiniryhmä -NH2
- amideihin, jolloin toiminnallinen ryhmä on amidiryhmä -CONH2
- aldehydeihin, jolloin toiminnallinen ryhmä on karbonyyliryhmä, jonka toinen substituentti on vety R-CHO
- karboksyylihappoihin, jolloin toiminnallinen ryhmä on karboksyyliryhmä -COOH
- ketoneihin, jolloin toiminnallinen ryhmä on karbonyyliryhmä, jonka molemmat substituentit ovat alkyylejä (R2)C=O
- estereihin, jotka ovat karboksyylaatin alkyloituja johdannaisia R-COO-R'
- tai muihin ryhmiin, tai useita eri ryhmiä sisältäviksi.
Orgaanisissa yhdisteissä on usein monia eri funktionaalisia ryhmiä, jolloin yhdiste kuuluu useaan luokkaan. Esimerkiksi allyylialkoholi eli propenoli on sekä alkoholi että alkeeni, ns. alkenoli. Orgaaniset yhdisteet nimetään niiden sisältämien funktionaalisten ryhmien mukaan.
Samanlaiset funktionaaliset ryhmät reagoivat yleensä samoin, riippumatta molekyylin muista osista, ja aiheuttavat aineelle vastaavanlaisia ominaisuuksia. Siten esimerkiksi kaikki karboksyylihapot ovat happamia, vaikka niissä olisi eripituinen hiiliketju (esimerkiksi etaanihappo CH3COOH, propaanihappo CH3CH3COOH, jne. ovat kaikki happamia). Sen sijaan saman määrän hiiliä sisältävät aineet, joissa on joitakin toisia funktionaalisia ryhmiä, ovat täysin erilaisia: etaani on neutraali, ei hapan eikä emäksinen kaasu, samoin propaani ja butaani; etanoli, propanoli, jne. ovat hyvin heikosti happamia.
Orgaanisten yhdisteiden nimeäminen
Orgaanisen yhdisteen nimen alku määräytyy pisimmän yhtenäisen hiiliketjun mukaan. Mikäli hiiliatomeita on
- 1, alkuosa: met-
- 2, alkuosa: et-
- 3, prop-
- 4, but-
- 5, pent-
- 6, heks-
- 7, hept-
- 8, okt-
- 9, non-
- 10, dek-
- Esimerkki 1: Neljästä hiiliatomista muodostunut avoketjuinen hiilivety alkaa but-. Mikäli kaikki hiilten väliset kovalenttiset sidokset ovat yksinkertaisia, hiilivety on alkaani eli butaani. Mikäli yhdisteessä olisi yksi kaksoissidos, yhdiste olisi alkeeni eli buteeni.
Funktionaalisen ryhmän paikka yhdisteessä tulee käydä ilmi nimestä. Paikka ilmaistaan nimen eteen liitetyllä pienimmällä sopivalla numerolla.
- Esimerkki 2: Buteeni on epätarkka nimitys. Toiminnallisen ryhmän (tässä tapauksessa kaksoissidoksen) paikka on ilmaistava. Mikäli kaksoissidos on ensimmäisessä kahden hiilen välisessä välikössä kummasta ketjun päästä laskien tahansa, yhdiste on 1-buteeni. Jos kaksoissidos olisi kummastakin hiilen päästä laskettaessa toisessa hiilten välisessä välikössä, yhdiste olisi 2-buteeni. Buteeni ei koskaan voi olla 3-buteeni, sillä sama yhdiste voidaan sopivammin ilmaista nimellä 1-buteeni aloittamalla lasku ketjun päästä, josta toiminnalliseen ryhmään on lyhyempi matka.
Yhdisteessä voi olla useita funktionaalisia ryhmiä, jolloin ne kaikki ilmaistaan yhdisteen nimessä.
- Esimerkki 3: Jos 1-buteenin kaksoissidoksen sisältävästä päästä toinen vety korvataan hydroksyylillä, yhdiste on 1-hydroksi-1-buteeni.
Yhdisteessä voi olla myös erillisiä pisimpään hiilivetyketjuun kuulumattomia hiilivetyryhmiä. Nekin ilmaistaan yhdisteen nimessä.
- Esimerkki 4: Jos 1-buteenin 2-asemassa sijaitsevan hiilen vety korvataan metyylillä -CH3, yhdiste on 2-metyyli-1-buteeni.
Yhdisteessä voi olla useita samoja funktionaalisia ryhmiä. Niiden paikat ilmaistaan pilkulla esimerkin mukaan.
- Esimerkki 5: Jos buteenissa on kaksi kaksoissidosta kummassakin päässä ensimmäisissä hiilten välisissä väliköissä, yhdiste on 1,3-butadieeni.
Yhdisteen mahdollinen syklisyys ilmaistaan etuliitteellä syklo-. Yhdisteen aromaattisuus ilmaistaan bentseenirenkaan mukaan bentseeninä.
- Esimerkki 6a: Syklinen heksaani on sykloheksaani. Jos sykloheksaaniin lisätään jonkun vedyn tilalle toiminnallinen ryhmä hydroksyyli, nimi on sykloheksanoli. Mikäli hydroksyylejä on kaksi, laskeminen suoritetaan kautta, josta on lyhyempi matka seuraavaan hydroksyyliin. Jos hydroksyylien välissä on yksi hiili, johon ei ole sitoutunut hydroksyyliä, yhdiste on 1,3-disykloheksanoli.
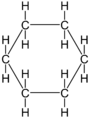
- Esimerkki 6b: Jos bentseenirenkaaseen on sitoutunut bromiatomi, yhdiste on bromibentseeni. Jos bromeja on kaksi ja ne ovat bentseenirenkaan vastakkaisilla puolilla, yhdiste on 1,4-dibromibentseeni.
Orgaanisten yhdisteiden mallintaminen
Yhdisteen molekyylikaavasta käy ilmi, kuinka monta kunkin alkuaineen atomia on yhdessä yhdisteen molekyylissä. Monesti molekyylikaavan kirjoitusasusta voidaan päätellä myös yhdisteen isomeeri.
Kun molekyylin rakenne kaikkine sidoksineen halutaan kuvata tarkasti, käytetään rakennekaavaa.
Rakennekaava

Rakennekaavasta käy ilmi molekyylin atomien ja sidosten järjestys. Orgaanisten yhdisteiden atomit merkitään rakennekaavoissa alkuainemerkein ja niiden väliset kovalenttiset sidokset viivoin. Yksi sidosviiva tarkoittaa yksinkertaista kovalenttista sidosta, kaksi rinnakkaista sidosviivaa tarkoittaa kaksoissidosta ja kolme sidosviivaa kolmoissidosta. Kahden hiilen välinen yksinkertainen kovalenttinen sidos mallinnetaan siis kahtena C:nä ja niiden välisenä sidosviivana: C-C.
Koska rakennekaava on kaksiulotteinen, siitä ei käy ilmi molekyylin todellinen muoto. Siitä ei myöskään selviä molekyylin atomien kokojen suhteet. Suurimmat molekyylit voivat olla lisäksi vaikeasti luettavia ja työläitä piirtää. Ilman oikeita sidoskulmia eli suorin kulmin piirrettynä piirros on lisäksi epärealistinen eikä kerro aineen reaktiivisuudesta.

Viivakaava
Hiilien ja vetyjen väliset sidokset jätetään viivakaavoissa merkitsemättä helpomman luettavuuden vuoksi. Tällöin paitsi vetyjen myös hiilten kemiallinen merkki jätetään kirjoittamatta – hiilet ilmaistaan sidosten välisinä kulmina.
Viivakaava on yleinen mallintamistapa yksinkertaisuutensa vuoksi. Sillä on myös helpompaa mallintaa kolmiulotteisia rakenteita. Orgaanisen kemian alan julkaisuissä käytetään viivakaavoja.
Kolmiulotteinen malli
Molekyylit voidaan piirtää myös palloiksi mallinnettujen atomien rypäinä. Tällöin molekyylin todellinen kolmiulotteinen muoto elektroniverhoineen käy selvimmin ilmi. Atomit esitetään yleensä värillisinä selkeyden vuoksi (atomeilla ei ole oikeasti väriä). Erityisesti isommissa yhdisteissä molekyylin osia voi jäädä piiloon.
Orgaanisen kemian reaktioita

Tyypillisiä orgaanisen kemian reaktioita ovat
- Palamisreaktio, jossa hiilivety reagoi hapen kanssa hiilidioksidiksi ja vedeksi
- Additioreaktio, jossa yhdisteeseen liittyy kaksois- tai kolmoissidoksen aukeamisen myötä atomeja tai atomiryhmiä
- Polyadditioreaktio, jossa monomeerit liittyvät additioreaktiolla polymeeriksi
- Eliminaatioreaktio, additioreaktion käänteisreaktio
- Substituutioreaktio, jossa molekyylin atomi tai atomiryhmä korvautuu toisella
- Kondensaatioreaktio, jossa molekyylit liittyvät yhteen, ja usein syntyy samalla vettä
- Polykondensaatioreaktio, jossa monomeerit liittyvät kondensaatioreaktiolla polymeeriksi
- Hydrolyysi, jossa vesimolekyyli hajottaa orgaanisen yhdisteen pienemmiksi yhdisteiksi
- Hapettuminen, jossa orgaanisen yhdisteen vedyn määrä pienenee ja/tai hapen määrä kasvaa
- Pelkistyminen, joka on hapettumisen käänteisreaktio
- Happo-emäsreaktio eli protonin H+ siirto hapolta emäkselle
- Neutraloituminen, jossa happo ja emäs reagoivat suolaksi ja vedeksi
Lähteet
- Lehtiniemi, Kalle: Mooli 2, Orgaanisen kemian perusteet. Otava, 2001. ISBN 951-1-16842-8
- Myers, Oldham, Tocci: ”Chapter 19, Carbon and Organic Compounds”, Holt Chemistry, s. 676–710. Holt, Rinehart & Winston, 2006. ISBN 0-03-039107-5 (englanniksi)
Viitteet
Aiheesta muualla
- Kemian etäopiskeluympäristö, Orgaaninen kemia, Käsitekartta orgaanisesta kemiasta – Opetus.tv
- Organic Chemistry Resources Worldwide (Arkistoitu – Internet Archive) (englanniksi)
- Organic Chemistry Portal (englanniksi)
- Organic chemistry – Khan Academy (englanniksi)